Зміст
- Початкові проблеми безпеки
- Ефективність
- Адміністрація
- Побічні реакції
- Протипоказання
- Хто повинен отримати щеплення
- Вивчення проблем безпеки
Це одна з трьох вакцин, що зараз використовуються для запобігання зараженню вірусом гепатиту В (ВГВ) у США. Сюди входять Recombivax HB, який був затверджений FDA в 1986 р., І лідер ринку Engerix-B, який отримав подібне схвалення в 2007 р. (Існує також третя комбінована вакцина, відома як Twinrix, яка вакцинує проти гепатиту A і B .)
Однією з головних переваг Геплісав-В є те, що він вимагає меншої кількості ін’єкцій за коротший проміжок часу - фактор, який може допомогти людям завершити серію, а не зупинятися коротко.
Початкові проблеми безпеки
Схвалення Heplisav-B завершило чотирирічну боротьбу за виведення вакцини на ринок. FDA раніше відхиляла препарат у лютому 2013 року та пізніше в листопаді 2016 року через загрозу безпеці щодо потенційного ризику гострого інфаркту міокарда (серцевий напад) та деяких аутоімунних захворювань.
Врешті-решт вакцина була схвалена на основі того факту, що для неї потрібні два уколи з інтервалом в один місяць. Натомість інші вакцини вимагають трьох уколів, розділених на один місяць, а потім на шість місяців.
Це було визнано важливим, оскільки одним з найбільших бар'єрів для вакцинації проти ВГВ було дотримання. Дослідження Департаменту інфекційних хвороб Університету Флориди в Джексонвіллі 2008 року повідомило, що із 707 осіб, які мають право на вакцинацію проти ВГВ, лише 503 отримали доступ до лікування і лише 356 завершили серію з трьох пострілів. Інші дослідження повідомляли про такі ж похмурі результати.
Зменшуючи розрив між ін’єкціями, FDA вважає, що переваги вакцини значно перевищують будь-які потенційні наслідки.
Ефективність
Схвалення Heplisav-B базувалося на даних трьох клінічних випробувань, у яких брали участь понад 14 000 дорослих учасників.Основне дослідження порівнювало дводозовий курс прийому Геплісав-В з тридозовою серією Енгерікс-В. Серед 6665 учасників, які брали участь у дослідженні, 95% досягли високого рівня захисту від Геплісав-В (як вимірюється за активністю антитіл) порівняно з 81% для Енгерікс-В.
У другому дослідженні, в якому взяли участь 961 людина з діабетом 2 типу (вважається, що мають високий ризик гепатиту В), повідомлялося, що Heplisav-B забезпечував високий рівень захисту у 90% тих, хто отримував вакцину, проти лише 65% у тих, хто отримував Engerix -В.
Більше того, відомо, що Геплісав-В забезпечує захист від усіх чотирьох основних серотипів, десяти генотипів (від A до J) та 40 субгенотипів.
Адміністрація
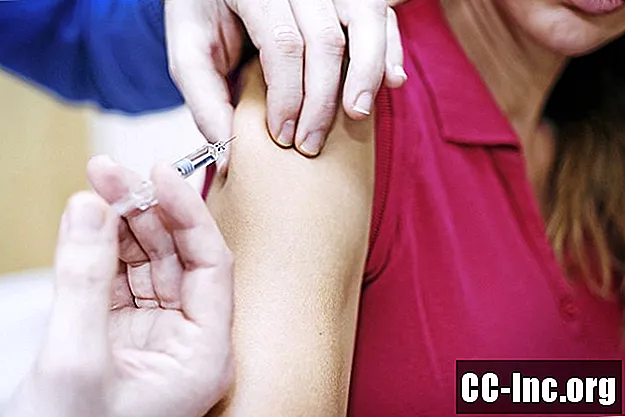
Геплісав-В вводиться шляхом внутрішньом’язової ін’єкції у верхній дельтовидний м’яз плеча. Вакцина не є живою вакциною (містить живий, ослаблений вірус), а натомість містить генетично модифікований антиген - по суті аватар вірусу - який не викликає хвороби, а стимулює захисну імунну відповідь.
Після того, як вам дадуть першу ін’єкцію 0,5 мілілітра (мл), другу поставлять через шість місяців.
Якщо з якихось причин ви не можете завершити серію протягом цього часу, поговоріть зі своїм лікарем щодо якнайшвидшого завершення серії. Навряд чи вам доведеться перезапускати серію.
Побічні реакції
Хоча деякі люди можуть відчувати реакцію на постріл, більшість випадків є легкими і вирішуються протягом декількох днів. За великим рахунком, реакції, якщо такі є, як правило, є більш глибокими після першого пострілу і менш значущими після другого.
Найбільш поширені симптоми (що спостерігаються у понад 2% пацієнтів) включають:
- Набряк у місці ін'єкції: 2,3%
- Почервоніння в місці ін’єкції: 4,1%
- Нездужання: 9,2%
- Головний біль: 16,9%
- Втома: 17,4%
- Біль у місці ін’єкції: 38,5%
Протипоказання
Геплісав-В не слід застосовувати особам, які в анамнезі мали важкі алергічні реакції, або тим, хто раніше мав реакцію на вакцину проти гепатиту В або будь-який з її компонентів, включаючи дріжджі. Повторне опромінення може призвести до потенційно небезпечної для життя алергічної реакції на все тіло, відомої як анафілаксія.
На сьогоднішній день не проводилось жодних досліджень на людях щодо впливу Геплісав-В під час вагітності та годування груддю. Однак дослідження на тваринах не повідомляло про небажані явища ні у вагітних лабораторних щурів, ні у їх нащадків після прийому 0,3 мл геплісава-В.
Хто повинен отримати щеплення
Гепатит В - це вірусне захворювання печінки, яке може перейти в хронічну форму та призвести до цирозу, раку печінки та смерті.
Згідно з доповіддю Американської робочої групи з питань превентивних послуг (USPSTF), десь від 700 000 до 2,2. Вважається, що в США мільйони людей заражені ВГВ. Частота заражень найвища серед дорослих від 30 до 49 років, які більшість заражаються або незахищеним статевим життям, або спільним використанням голки.
Лікування гепатиту В не існує, але ефективна вакцинація може запобігти захворюванню. З цієї причини Консультативний комітет з практики імунізації (ACIP) і в даний час рекомендує всім дітям отримати першу дозу вакцини проти ВГВ при народженні та пройти серію від шести до 18 місяців. Дітям старшого віку та підліткам, які не отримували вакцину проти ВГВ, також слід робити щеплення.
Центри з контролю та профілактики захворювань також рекомендують вакцинувати всіх дорослих з високим ризиком розвитку ВГВ. До них належать:
- Особи, які живуть або мають статеві стосунки з хворим на гепатит В
- Сексуально активні особи, які не перебувають у тривалих, взаємно моногамних стосунках
- Особи, які шукають тестування або лікування інфекції, що передається статевим шляхом
- Чоловіки, які займаються сексом з чоловіками
- Люди, які живуть з ВІЛ
- Люди, які діляться голками, шприцами чи іншою атрибутикою для наркотиків
- Медичні працівники та інші особи, які мають ризик потрапляння крові
- Люди з термінальною стадією захворювання нирок
- Люди з хронічними захворюваннями печінки
- Люди, які страждають на діабет у віці до 60 років, починали якомога швидше після діагностики
- Міжнародні мандрівники до регіонів із середнім та високим рівнем гепатиту В.
- Особи, які іммігрували з країн із середнім та високим рівнем гепатиту В або діти, народжені від батьків, які іммігрували з цих країн до їх народження
- Той, хто вважає, що потрапляє в групу ризику
USPSTF в даний час не рекомендує вакцинацію проти гепатиту В для загального дорослого населення, оскільки не було доведено, що така практика знижує ризик захворювань печінки або смерті.
Вивчення проблем безпеки
Незважаючи на переважно позитивний прийом з боку державних служб охорони здоров'я, проблеми безпеки продовжують переслідувати вакцину, враховуючи її ранні відмови від FDA.
FDA спочатку відхилила вакцину в 2013 році на основі одного з її компонентів, відомого як CpG 1018. Це сполука, яка використовується для посилення імунодефіцитних можливостей вакцини, та саме та, яка дозволяє проводити серію з двох пострілів.
Відповідно до відповіді FDA, CpG 1018, як вважалося, потенційно може спровокувати певні аутоімунні порушення, включаючи захворювання щитовидної залози. Хоча ранні дослідження не показали статистичної різниці між Heplisav-B та Engerix-B, заявка була відхилена просто тому, що обсяг дослідження на той час вважався замалим.
На момент повторного звернення 14 238 людей зазнали дії вакцини, лише два випадки тиреоїдиту Хашимото (форма захворювання щитовидної залози) і один випадок вітіліго.
Пізніше, у 2016 році, вакцину також було відхилено, коли в одному дослідженні повідомлялося про більшу кількість очікуваних серцевих подій, включаючи серцеві напади. У цьому випадку FDA вимагала додаткової інформації щодо будь-яких не пов'язаних факторів, які могли б допомогти краще пояснити результати.
Після розгляду додаткових даних FDA надала схвалення. Остаточні результати випробувань повідомили про 0,1% ризик серцевого нападу у людей, яким вводили Геплісав-В, проти 0,2% при застосуванні Енгерікс-В.